Axit Nitric là 1 trong trong mỗi thích hợp Hóa chất đem tính axit và lão hóa mạnh được dùng cực kỳ rộng thoải mái vô cuộc sống lúc bấy giờ, nhất là với nghành nghề phát hành công nghiệp. Vậy hóa hóa học này còn có những đặc điểm đặc thù gì, người tớ pha chế bọn chúng bằng phương pháp này và nó được ứng khí cụ ra sao trong số lĩnh vực? Hãy nằm trong VIETCHEm đi tìm kiếm hiểu về axit nitric qua loa nội dung nội dung bài viết tiếp sau đây nhé
I. Axit Nitric – HNO3 là gì?
Axit nitric đem công thức chất hóa học là HNO3, được gọi là hỗn hợp nitrat hidro hoặc còn được gọi là axit nitric khan. Axit này được tạo hình ở vô bất ngờ, tạo nên kể từ những trận mưa vì thế sấm và sét tạo nên trở thành.
Bạn đang xem: Axit nitric (HNO3) là gì? Tính chất, ứng dụng, lưu ý - Vietchem
II. Cấu tạo phân tử Axit Nitric – HNO3
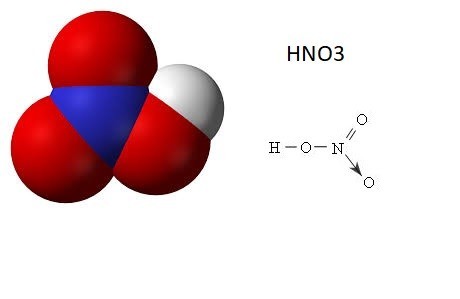
Cấu tạo nên phân tử - HNO3
III. Tính hóa học cơ vật lý của axit nitric
- Axit nitric tồn bên trên ở dạng hóa học lỏng hoặc khí, ko color, tan nhanh chóng nội địa (C, 65%). Hợp hóa học này vô bất ngờ sẽ có được gold color nhạt nhẽo vì thế sự tụ tập của oxit nito.
- HNO3 là 1 trong axit đem tính bào mòn cao, dễ dàng bắt lửa và cực kỳ độc.
- Axit nitric mật độ 86% khi nhằm ngoài bầu không khí sẽ có được hiện tượng kỳ lạ sương White bốc lên.
- Tỷ trọng của axit nitric tinh ma khiết: 1511 kg/m3
- Nhiệt chừng tấp nập đặc: -41 chừng C
- Nhiệt chừng sôi: 83 chừng C
- Dưới ứng dụng của khả năng chiếu sáng, axit nitric bị phân diệt tạo nên trở thành nito dioxit NO2 ( nhiệt độ chừng thường).
4HNO3 → 4NO2 + 2H2O + O2
-
Cần bảo vệ HNO3 trong số chai lọ tối color, tách điểm đem ánh sáng và bảo vệ ở nhiệt độ chừng bên dưới 0 chừng C.
- Axit nitric hoàn toàn có thể hòa tan nito dioxit trở thành hỗn hợp làm nên màu vàng hoặc đỏ hỏn ở nhiệt độ chừng cao. Vấn đề này tác động rất to lớn cho tới những đặc thù cơ vật lý của hóa học này, nhất là áp suất khá bên trên hóa học lỏng, sắc tố hỗn hợp, nhiệt độ chừng sôi,... tùy thuộc vào mật độ NO2.
- Khi chưng chứa chấp láo thích hợp HNO3 và H2O tớ thu chiếm được azeotrope đem mật độ 68% HNO3 và sôi ở 120,5 chừng C, 1atm.

Axit nitric tồn bên trên ở dạng hóa học lỏng hoặc khí, ko color, tan nhanh chóng vô nước
IV. Tính Hóa chất của HNO3
Axit nitric là 1 trong hỗn hợp nitrat hydro đem công thức chất hóa học HNO3 . Đây là 1 trong axit khan, là 1 trong monoaxit mạnh, đem tính lão hóa mạnh hoàn toàn có thể nitrat hóa nhiều thích hợp hóa học vô sinh, đem hằng số cân đối axit (pKa) = −2.
Axit nitric là 1 trong monoproton chỉ tồn tại một sự phân ly nên vô hỗn hợp, nó bị năng lượng điện ly trọn vẹn trở thành những ion nitrat NO3− và một proton hydrat, hoặc hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric đem đặc điểm của một axit thông thường nên nó thực hiện quỳ tím gửi quý phái red color.
- Tác dụng với bazo, oxit bazo, muối bột cacbonat tạo nên trở thành những muối bột nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric ứng dụng với kim loại: Tác dụng với đa số những sắt kẽm kim loại trừ Au và Pt tạo nên trở thành muối bột nitrat và nước .
Kim loại + HNO3 đặc → muối bột nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối bột nitrat + NO + H2O
Kim loại + HNO3 loãng giá buốt → muối bột nitrat + H2
Mg(rắn) + 2HNO3 loãng giá buốt → Mg(NO3)2 + H2 (khí)
- Nhôm, Fe, crom thụ động với axit nitric đặc nguội vì thế lớp oxit sắt kẽm kim loại được tạo nên đảm bảo bọn chúng không xẩy ra lão hóa tiếp.
- Tác dụng với phi kim (các yếu tắc á kim, nước ngoài trừ silic và halogen) tạo nên trở thành nito dioxit nếu trong trường hợp là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
Phường + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối bột nhưng mà sắt kẽm kim loại vô thích hợp hóa học này ko lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Xem thêm: Cách tính tổng trong excel | Công thức, lệnh lọc nhanh nhất
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với thích hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan vô HNO3, HgS ko ứng dụng với HNO3.
- Tác dụng với khá nhiều thích hợp hóa học hữu cơ: Axit nitric đem kĩ năng đập phá diệt nhiều thích hợp hóa học cơ học, nên tiếp tục cực kỳ nguy nan nếu như nhằm axit này xúc tiếp với khung hình người.
Trong bất ngờ, axit nitric được tạo nên kể từ những trận mưa rộng lớn đem sét, tạo ra những trận mưa axit.
1. Điều chế axit nitric - HNO3 vô chống thí nghiệm
Người tớ cho tới muối bột natri nitrat tinh ma thể ứng dụng với axit sunfuric đặc, chưng chứa chấp láo thích hợp này bên trên nhiệt độ chừng sôi của axit nitric là 83 °C cho tới lúc còn lại hóa học kết tinh ma white color. Tuy nhiên, cách thức này chỉ tạo nên một lượng nhỏ axit.
H2SO4 đặc + NaNO3 (tinh thể) → HNO3 + NaHSO4
Axit nitric bốc sương đỏ hỏn chiếm được hoàn toàn có thể gửi trở thành axit nitric white color. Khi triển khai thực nghiệm , những khí cụ nên thực hiện kể từ thủy tinh ma, nhất là bình cổ cong nguyên vẹn khối vì thế axit nitric khan.
2. Điều chế axit nitric - HNO3 vô công nghiệp
Axit nitric loãng hoàn toàn có thể cô đặc cho tới 68% axit với cùng một láo thích hợp azeotropic với 32% nước. Để chiếm được axit đem mật độ cao hơn nữa, tổ chức chưng chứa chấp với axit sunfuric H2SO4. H2SO4 đóng tầm quan trọng là hóa học khử tiếp tục hít vào lại nước.
4NH3 + 5O2 → 4NO + 6H2O (Pt, 850oC)
2NO + O2 → NO2
4NO2 + O2 + 2H2O → 4HNO3
Dung dịch axit nitric công nghiệp thông thường đem mật độ 52% và 68%. Việc phát hành axit nitric được triển khai vày technology Ostwald vì thế Wilhelm Ostwald sáng tạo.
VI. Ứng dụng của axit nitric - HNO3 vô thực dắt là gì?

Một số phần mềm của axit nitric - HNO3
1. Trong chống thí nghiệm
- Hợp hóa học axit nitric đa số được dùng thực hiện dung dịch test tương quan cho tới clorit. Người tớ cho tới HNO3 ứng dụng với kiểu test, tiếp sau đó cho tới hỗn hợp bạc nitrat vô láo thích hợp nhằm dò xét kết tủa White của bạc clorua.
- Ngoài đi ra, axit nitric còn được dùng nhằm pha chế muối bột nitrat.
2. Trong công nghiệp
- Axit nitric 68% được dùng nhằm sản xuất dung dịch nổ bao hàm trinitrotoluen (TNT), nitroglycerin, cyclotrimethylenetrinitramin (RDX), và những loại phân bón chứa chấp ni-tơ như phân đạm một lá nitrat amoni NH4NO3, những muối bột nitrat như Ca(CO3)2, KNO3,...
- HNO3 mật độ 0,5 - 2 % được sử dụng thực hiện thích hợp hóa học nền nhằm mục tiêu xác lập đem sắt kẽm kim loại tồn bên trên vô hỗn hợp hay là không. Người tớ gọi này đó là nghệ thuật ICP-AES và ICP-MS. Để thành phẩm phân tách được chuẩn chỉnh xác cần dùng HNO3 tinh ma khiết vô cùng.
- HNO3 phản xạ với đa số với những thích hợp hóa học cơ học nên nó được dùng nhiều vô ngành luyện kim, tinh ma thanh lọc và xi mạ. Khi cho tới axit nitric ứng dụng với axit clorua, tớ được hỗn hợp cường toan đem kĩ năng hòa tan và và bạch kim.
- Axit nitric còn được dùng vô phát hành những hóa học cơ học, tô, bột color, dung dịch nhuộm vải vóc.
- HNO3 còn được sử dụng thực hiện dung dịch tẩy color nhằm phân biệt morphine và heroin.
- Hợp hóa học HNO3 được dùng nhằm phát hành nitrobenzen - chi phí hóa học nhằm phát hành anilin và những dẫn xuất của chính nó - phần mềm then chốt vô phát hành sợi aramit, bọt xốp polyuretan và dược phẩm.
- Axit nitric còn là một thích hợp hóa học trung gian ngoan vô phát hành những hóa học kết bám, hóa học bộc phủ, hóa học bịt kín và những hóa học đàn hồi lên đường kể từ toluen diisoxyanat.
- Trong những xí nghiệp sữa, người tớ sử dụng HNO3 thực hiện hóa học tẩy cọ những đường ống dẫn, mặt phẳng sắt kẽm kim loại.
- Axit nitric còn được dùng nhằm vô hiệu những tạo nên hóa học và cân đối lại chừng chi tiêu chuẩn chỉnh của nước.
- Một trong mỗi phần mềm không giống cho tới IWFNA là 1 trong hóa học lão hóa vô nhiên liệu lỏng thương hiệu lửa.
VII. Mua axit nitric ở đâu bên trên Hà Thành, thành phố Hồ Chí Minh Hồ Chí Minh
VIETCHEM là doanh nghiệp nhập vào và phân phối những loại hóa hóa học công nghiệp, khí cụ thực nghiệm, trang bị khoa học tập nghệ thuật tiên phong hàng đầu nước ta, sẽ có được sự cỗ vũ, tin cậy yêu thương của quý khách hàng vô toàn nước. Với khối hệ thống rộng lớn 50 xe tải lớn nằm trong lực lượng nhân viên cấp dưới ship hàng nhanh chóng nhẹn, hăng hái và ý thức trách móc nhiệm với việc làm, Cửa Hàng chúng tôi khẳng định tiếp tục đáp ứng đúng lúc cho tới quý khách hàng những thành phầm rất chất lượng vô thời hạn nhanh nhất có thể với nấc giá bán tuyên chiến đối đầu.
Xem thêm: Khám phá Ý nghĩa màu xanh lá cây trong tính yêu và cuộc sống
Các thành phầm hóa hóa học của VIETCHEM đều được kiểm lăm le unique nghiêm nhặt kể từ mối cung cấp nguyên vật liệu nguồn vào cho tới trở thành phẩm sau cùng. Mọi tiến độ phát hành kể từ pha trộn cho tới gói gọn, ship hàng đều được giám sát ngặt nghèo vày những kỹ sư đem trình độ cao, chi tiêu chuẩn chỉnh vận hành unique ISO 9001:2015 và vận hành môi trường thiên nhiên bám theo chi tiêu chuẩn chỉnh khối hệ thống ISO 14001: năm ngoái.
Hiện ni doanh nghiệp Cửa Hàng chúng tôi đang được phân phối hỗn hợp Nitric acid HNO3 68%, Hàn Quốc. Nếu chúng ta đang được do dự và ko biết nên chọn mua axit nitric ở đâu nhằm đáp ứng unique, hãy nhấc máy lên và gọi cho tới số đường dây nóng 0826 010 010 của VIETCHEM và để được tư vấn và làm giá cực tốt.
Tham khảo thêm:
- AXIT SUNFURIC - HÓA CHẤT CÔNG NGHIỆP QUAN TRỌNG NHẤT HIỆN NAY











Bình luận